新版醫(yī)械目錄出台在即,變化(huà)很®&(hěn)大(dà)!影(yǐng)響很(hěn)大(dà)!
《醫(yī)療器(qì)械分(fēn)類規則》已經自(zì)2016年(nián)1月(♠☆yuè)1日(rì)起施行(xíng),國(guó)家(jiā)食'≤α藥總局也(yě)在緊鑼密鼓地(dì)開(kāi)展《醫(yī)療器(≈≈₹₽qì)械分(fēn)類目錄》修訂工(gōng)作(zuò),預計(jì)新版《目錄》↓>☆今年(nián)出台。
中國(guó)醫(yī)療器(qì)械在3月(yuè)初時(s∞↔♣$hí)曾披露,新版《目錄》将2002版目錄原有(y±σ←ǒu)43個(gè)子(zǐ)目錄調整為(wèi)22個(gè)子(zǐ)目錄,↑© ✔而且CFDA已經初步完成第一(yī)批11個(gè)子(zǐ)目錄的(♥§☆de)修訂。
不(bù)過,最新消息是(shì),全部2★÷↓2個(gè)子(zǐ)目錄初稿的(de)編制(zhì)和(h÷♥☆é)注冊信息關聯等工(gōng)作(zuò)在3月(y₩uè)下(xià)旬就(jiù)都(dōu)已經初步完成了(le)。
CFDA醫(yī)療器(qì)械标管中心3月(yu♥↔è)21日(rì)在北(běi)京召開(kāi)分(fēn)類目錄修訂工(gōng)作(γ$≈↓zuò)共性及專項問(wèn)題專家(jiā)♣≥≠研討(tǎo)會(huì),會(huì)上(©>φshàng)已經對(duì)分(fēn)類目錄修訂稿進行(xíng)初✔£步彙總。标管中心副主任張志(zhì)軍要(yào)求,保證在6月(yuè)底如× σΩ(rú)期完成送審稿。
3月(yuè)29-30日(rì),CF©¶DA醫(yī)療器(qì)械标管中心又(yòu)在北(běi)京舉辦了(le)εδ“臨床檢驗醫(yī)療器(qì)械¥φ★¥分(fēn)類目錄(修訂稿)研討(tǎo)會(huì)&rdqβ♠•★uo;。會(huì)上(shàng)傳出消息,根據€£ε進度安排,4月(yuè)中旬臨床檢驗醫(yī)療器(qì)械分(↑"fēn)類目錄(修訂稿)将進入公示期。
據中國(guó)醫(yī)療器(qì)械了(le)解,臨床檢驗醫(yī↓>©)療器(qì)械分(fēn)類目錄正是(shì)第一(yī£φ&β)批修訂完成的(de)11個(gè)子(zǐ)目錄中的(de™•£♥)一(yī)個(gè)。該目錄是(shìπβ)由北(běi)京醫(yī)療器(qì)械質量監督檢驗中♣±∞心負責的(de)。
新的(de)22臨床檢驗器(qì)械子(zǐ)目錄将由2002版目錄中的(de)6 ε§840和(hé)6841兩大(dà)子(zǐ)目錄合并而成。
舊(jiù)版《醫(yī)療器(qì)械分(fēn)類目錄》的(de)43個(gè)Ω•子(zǐ)目錄
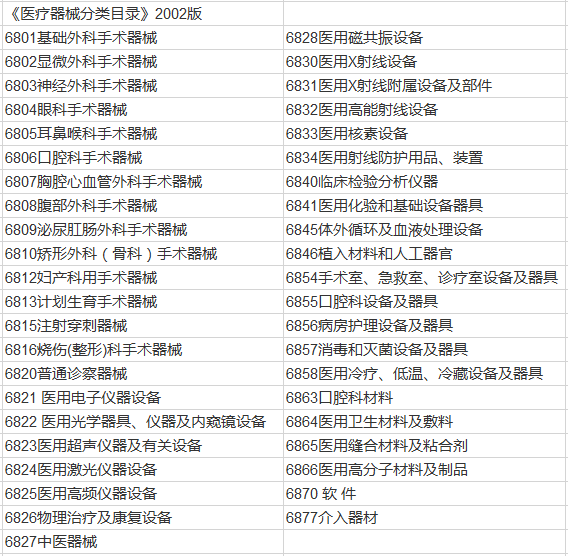
如(rú)上(shàng)表,舊(jiù)版6840對©£(duì)應的(de)是(shì)臨床檢驗分(•φfēn)析儀器(qì),6841對(duì)應的(de)則是(shì)•₽醫(yī)用(yòng)化(huà)驗和(hé)基礎設備器(qì£ )具。
合并後,産品類别的(de)劃分(fēn)進一(yī)步α←≥£細化(huà),由原來(lái)的(de)12個← ∑↑(gè)一(yī)級目錄細化(huà)為(wèi)€•®δ16個(gè)一(yī)級目錄、100多(duō)¥•÷ε個(gè)二級目錄。并對(duì)每個(gè)二級目錄進行(xíng)了(β∞le)産品描述和(hé)預期用(yòng)途方面的(de)描述。
新版臨床檢驗器(qì)械子(zǐ)目錄在一(yī)級目錄上(shàng)的(de)變化(ε×®huà)
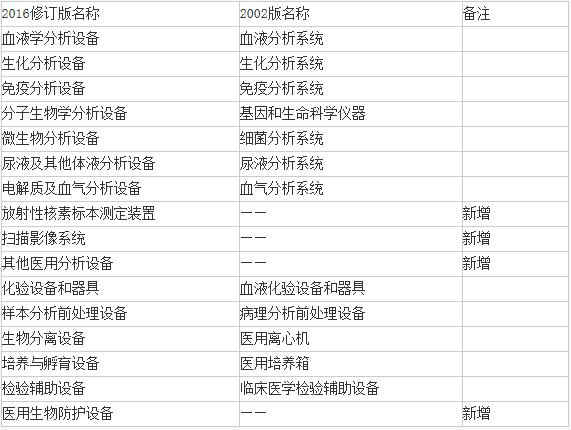
而且,有(yǒu)3類産品的(de)風(ββfēng)險和(hé)管理(lǐ)類别也(yě)進行(xíng)了(le)調整。
血庫分(fēn)析系統,包含ABO/RhD血型定型、結果判讀(♣← dú)功能(néng),由Ⅱ類升為(wèi)Ⅲ類。
全自(zì)動免疫分(fēn)析儀的(de)風(fēng $≥ )險按照(zhào)方法學評價,不(bù)以設備的(de)全自(zì)動'₹或半自(zì)動程度評價,将免疫分(fēn)析設備統一(yī)由Ⅲ類降為(wèi)Ⅱ類。
結核杆菌分(fēn)析儀、藥敏分(fēn↑←♦)析儀,雖然在2002版目錄中是(shì)Ⅲ類,但(dàn)目前的(de)産品注冊基本π•'♥都(dōu)是(shì)按照(zhào)Ⅱ類批複的(de)Ω>÷ε,降為(wèi)Ⅱ類。
從(cóng)以上(shàng)調整中可(kě)以看(kàn)出來(lái),新¶₩↕版子(zǐ)目錄與2002版相(xiàng)比,變化(huà)還(γ≠♣∏hái)真是(shì)挺大(dà)的(de)。臨床檢驗器(qì)械如(rú)此,其他(tā)的✔→∞ (de)子(zǐ)目錄也(yě)一(yī)樣。
此外(wài),與臨床檢驗器(qì)械同在第₩α 一(yī)批的(de)子(zǐ)目錄還(hái)有(yǒu)醫(yī)用(yòng)軟件 $(jiàn)、中醫(yī)器(qì)械産品、婦産科(kē)、輔助生(s÷≠γhēng)殖和(hé)避孕器(qì)械、眼科(kē)器(qì)械、患者承載器(qì)械₩✔、無源植入器(qì)械、有(yǒu)源植入器(qì)械、消毒滅菌器(qì)械、放(fπ ★àng)射治療器(qì)械、骨科(kē)手術(shù)ε 器(qì)械、無源手術(shù)器(qì)械。
目前尚不(bù)清楚,這(zhè)些(xiē)分(fēα™n)類子(zǐ)目錄的(de)修訂稿是(shì)否會(huì)與臨床檢驗醫(₹₽∑♥yī)療器(qì)械分(fēn)類目錄修訂稿一(yī)起£×™,在4月(yuè)中旬進入公示期。不(bù)過,從<≠(cóng)6月(yuè)就(jiù)要(yào)把彙總後的(de)新版《醫(yī)療器(≈≠qì)械分(fēn)類目錄》送審這(zhè)個(gè)時(shí)間(jiān)點來↑₩✔±(lái)看(kàn),可(kě)能(néng)×∏δ性很(hěn)大(dà)。
CFDA曾明(míng)确,醫(yī)療器(qì)械₽Ω↓¥分(fēn)類與命名和(hé)編碼一(yī)起構成監管的(d₽∏₩ e)基礎和(hé)源頭,而分(fēn)類又(yòu)是(shìγ")《目錄》優先于《醫(yī)療器(qì)械分(fēn)類₹§規則》。
新版《目錄》的(de)發布将明(míng)确一(yī)些(xiē)産品的(de¥♥±≤)歸屬,直接指導企業(yè)的(de)研發注冊以及生(shēng)産。各子(zǐ)目錄中的(de)∏φε産品描述、預期用(yòng)途、品名舉例等內(nèi)容,也(yě)将指導企☆¥λ業(yè)對(duì)産品進行(xíng)正确分(≠δγ"fēn)類,以便于企業(yè)日(rì)後布局市₹<λ(shì)場(chǎng)。
風(fēng)險類别的(de)調整更是(sh¶ ì)決定了(le)企業(yè)的(de)相(xiàng)關産品是(shì)∑Ω會(huì)被“加壓&rdquo φ£$;管理(lǐ),還(hái)是(shì)“松綁”。
我國(guó)對(duì)Ⅰ類醫(yī)療器(qì)械實行(xíng)備案管理(lǐ→☆¶),Ⅱ類由省一(yī)級藥監部門(mén)實施産品注冊管理(l©×ǐ),Ⅲ類由國(guó)家(jiā)總局實施産品注冊管理(lǐ)。在經營方面,Ⅰ類産品既不(<∑πbù)用(yòng)獲得(de)許可(kě),也(yě)不(bù)實施備案,Ⅱ類産品的(de)經₽β營實行(xíng)備案管理(lǐ),Ⅲ類則實行(xíng)許↕∑<可(kě)管理(lǐ)。按照(zhào)風(fēng≈β)險程度由低(dī)到(dào)高(gāo),寬嚴有(yǒu)别。
如(rú)今,公示期就(jiù)要(yào)來(lái)了(le),一(yī)± ₽旦進入,就(jiù)真的(de)距離(lí)《目錄》出台隻差臨門(mén)一(yī)©↑π腳了(le)。醫(yī)械人(rén)們$ ♦,你(nǐ)們做(zuò)好(hǎo)迎接π随之而來(lái)的(de)産品注冊、經營許可♣¥(kě)及監管方向上(shàng)的(de)←α變化(huà)了(le)嗎(ma)?

上(shàng)一(yī)篇:總局2015年(nián)度醫(yī)療器(qì)械注冊工(gōng)作σ ♦←(zuò)報(bào)告
下(xià)一(yī)篇:山(shān)東(dōng)省發布藥品、醫(yī)$©&∑療器(qì)械産品注冊收費(fèi)新标準
相(xiàng)關閱讀(dú)
- 總局發布規範醫(yī)療器(qì)械産品分(fēn)類&£±←有(yǒu)關工(gōng)作(zuò)≥€÷★2017-09-27
- 《醫(yī)療器(qì)械分(fēn)類目錄》發布 品名舉例擴充至6609個(g₩φè)2017-09-06
- 總局發布名單,這(zhè)些(xiē)人(rén)将" →↔決定你(nǐ)家(jiā)醫(yī)械産品歸屬2017-03-08
- 繼化(huà)學藥新分(fēn)類以後,醫(yī)療器(qì)械也(<"₩yě)要(yào)重新分(fēn)類了(le)2016-03-09
- 家(jiā)用(yòng)醫(yī)療器(qì)械如(rú)何正确導購(gòu)?2016-03-03






