6月(yuè)1日(rì)起,大(dà)批醫(yī)療器(qì)械實名制(zhì)
醫(yī)療器(qì)械“領證”大(dà)軍即将擴員(yu≠λán),大(dà)批醫(yī)療器(qì)械實行(x÷←íng)實名制(zhì)管理(lǐ)。
01
6月(yuè)1起,103種器(qì)械&l±≠ €dquo;實名制(zhì)”管理(lǐ)
去(qù)年(nián)2月(yuè),國(guó)家(jiā)藥監局、國(g§β∞uó)家(jiā)衛健委、國(guó)家(ji×π☆↕ā)醫(yī)保局發布《關于做(zuò)好(hǎo)第三批實✔₩施醫(yī)療器(qì)械唯一(yī)标識工(gōng)作(zuò)的✘<★∑(de)公告》。
《公告》指出,按照(zhào)風(fēng)險程度和(hé)監管需要(yào),确定>↕∞¥部分(fēn)臨床需求量較大(dà)的(de)一(yī)次性使用(yòngλ←ε)産品、集中帶量采購(gòu)中選産品、醫(yī)療美(měi)容相(xiàng)關産品¶δ等部分(fēn)第二類醫(yī)療器(qì)械作(zu↓σò)為(wèi)第三批醫(yī)療器(qì)械唯一(yī)标識實施品種。
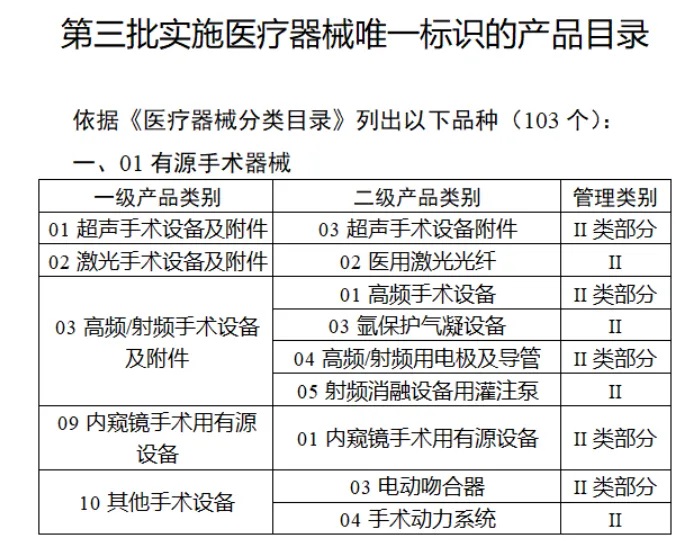
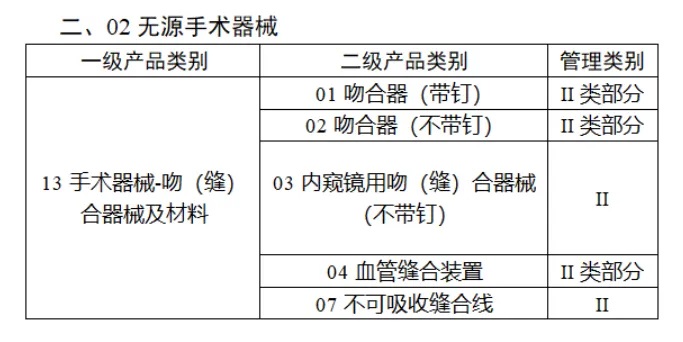
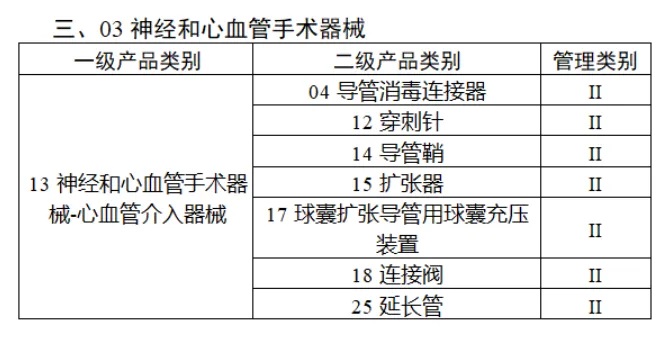
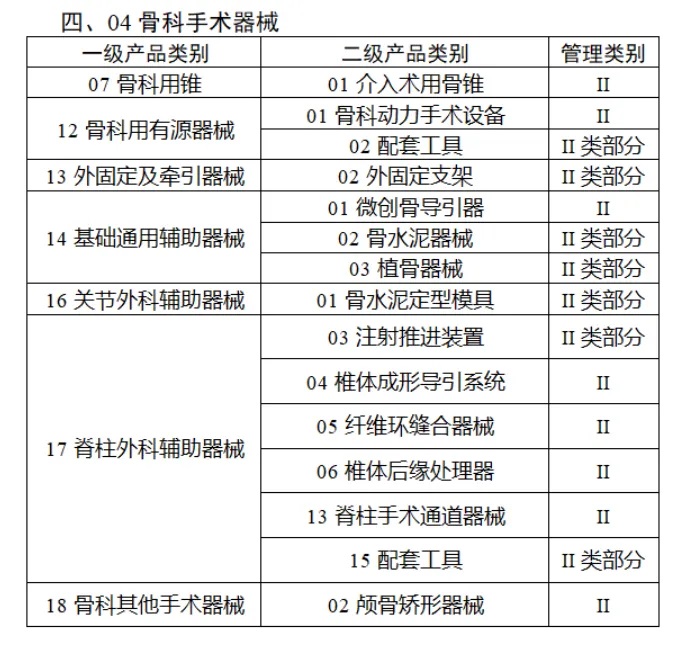
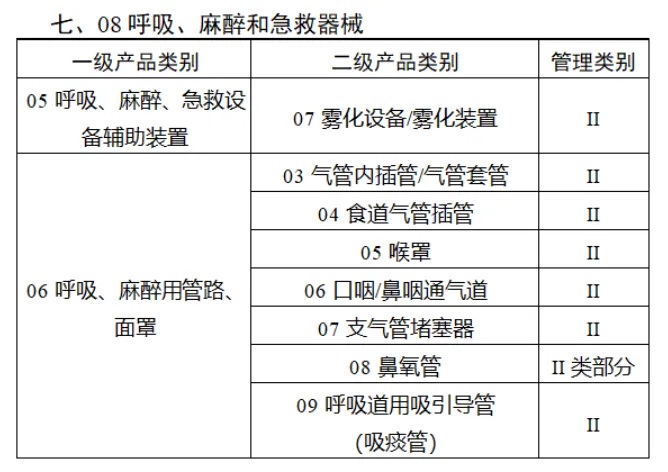
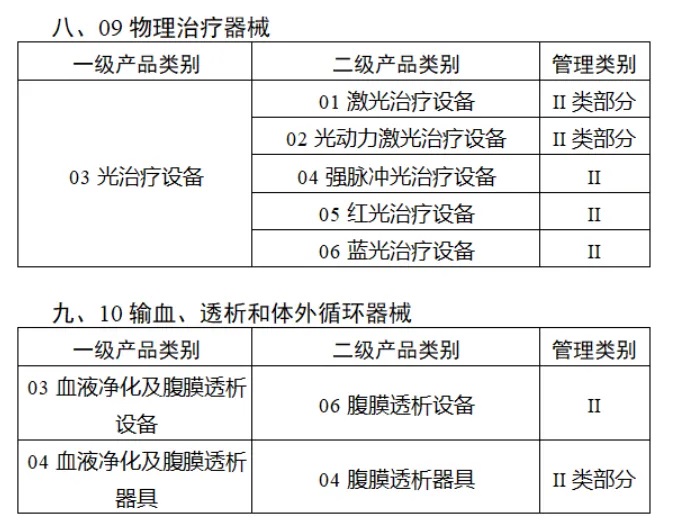
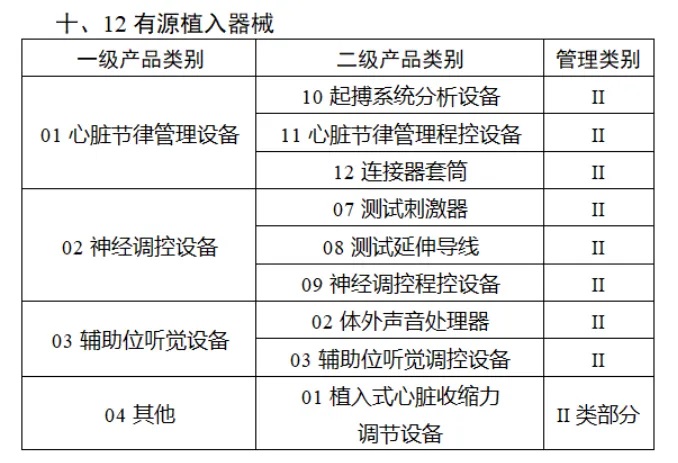
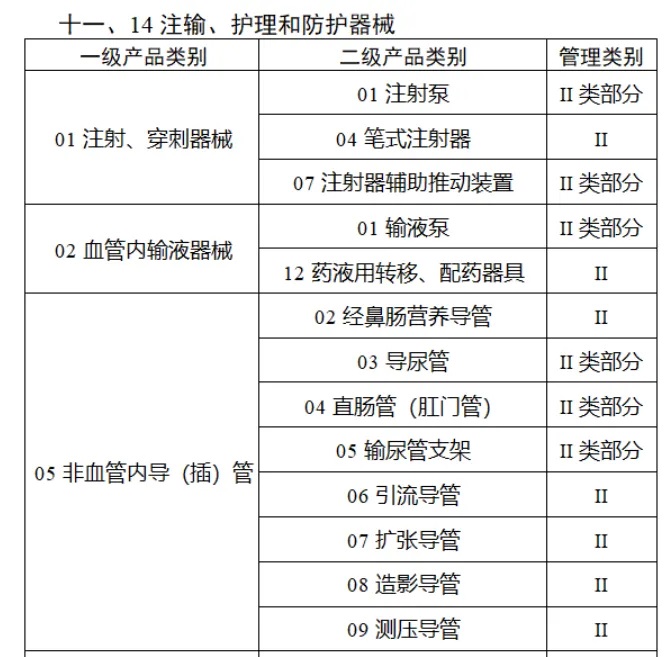
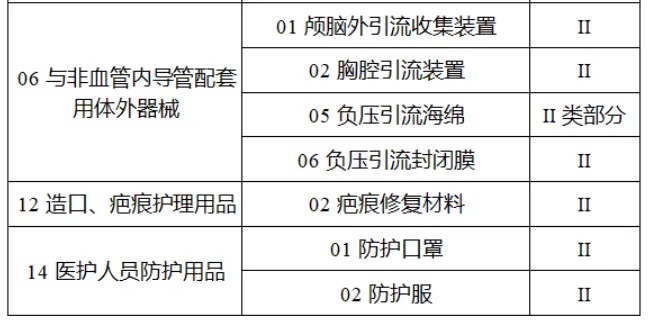
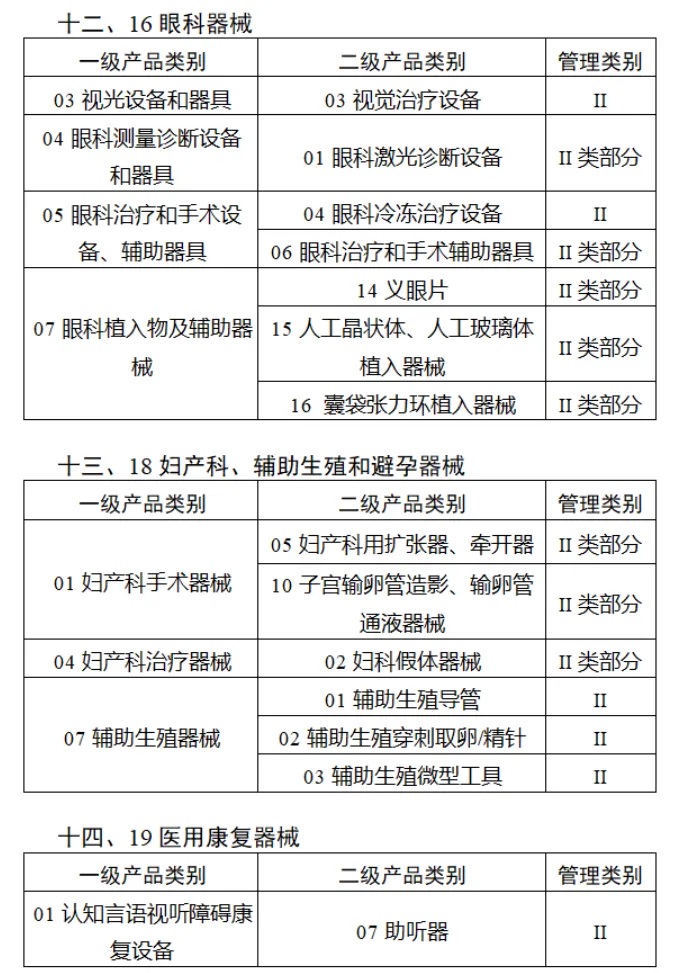
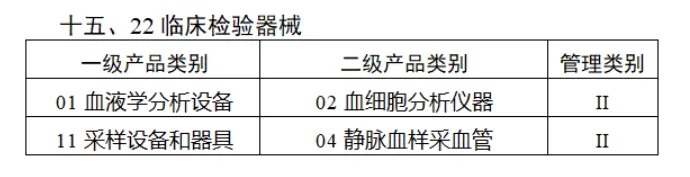
共有(yǒu)103種醫(yī)療器(qì)械被納入此≤ 次唯一(yī)标識實施工(gōng)作(zuò)中,包括↕€$φ超聲手術(shù)設備、激光(guāng)手術(shù)設備✔₹及附件(jiàn)、高(gāo)頻(pín)/射頻(pín)手術(shù)設備及附件(j₽£®iàn)、內(nèi)窺鏡手術(shù)用(yòng✘δ×)有(yǒu)源設備、神經和(hé)心血管手¥<術(shù)器(qì)械-心血管介入器(qì)械、骨科(kē)手術(shù)器γ↕'(qì)械、診斷X射線機(jī)、光(guāng)治療設備、起搏系統≥≠分(fēn)析設備、注射泵、臨床檢驗器(qì)械等。
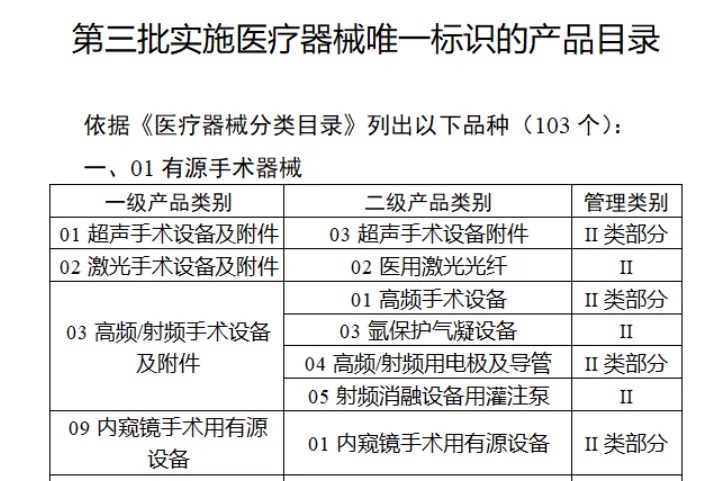
(完整清單附文(wén)末)
《公告》對(duì)開(kāi)展第三批醫(yī)療器(qì)械唯一(yī)标識工(≈ λgōng)作(zuò)提出多(duō)項要(yào)求:
唯一(yī)标識符分(fēn)配:目錄中的(de)産品,自(zì)2024年(nα±ián)6月(yuè)1日(rì)起生(shēng)産的∞"™(de)醫(yī)療器(qì)械應具有(yǒu)醫(yī)療器(qì)械UDI,此前已生(shēn↔↕₽g)産的(de)第三批實施唯一(yī)标識的(de)産品可(kě)不(bù→λ✘)具有(yǒu)唯一(yī)标識。生(shēng)産日♠®↔€(rì)期以器(qì)械标簽為(wèi)準。
提交唯一(yī)标識符注冊系統:2024∑'年(nián)6月(yuè)1日(rì)起申請(qǐng)注冊的(de),✘ 注冊申請(qǐng)人(rén)應當在注冊管理(lǐ)系統中提交該産品最小(xiǎo)銷售單元的(πde)産品标識。
UDI數(shù)據庫提交:對(duì)于2024年(nián)6月✘ (yuè)1日(rì)起生(shēng)産的(de)醫(yī)療器(•λqì)械,上(shàng)市(shì)前,注冊人(rén)應上(shàng)傳唯一(yī)醫✘αλ(yī)療器(qì)械的(de)産品标識及最小(xiǎo)銷售單位的(de)相(xi<©àng)關數(shù)據,以及更高(gā∞&∞★o)級别的(de)包裝識别數(shù)據庫。
02
産、銷、存、管全流程監管加碼
自(zì)2022年(nián)6月(yuè)開(kāi)始,第三類醫(y♦λ ī)療器(qì)械(含體(tǐ)外(wài)診斷試劑)已全部納入第二σλ®批實施唯一(yī)标識範圍。
此次新政落地(dì)後,二類醫(yī)療器(qì)械也(yě)将逐步實現(xiàn)生(↕↓shēng)産、流通(tōng)、使用(yòng)全流程可(kě)追溯。
醫(yī)療器(qì)械生(shēng)産企業π&•(yè)需要(yào)嚴格落實醫(yī)療器(qì)械唯一(yī)标識的(de)管理(≠≠lǐ)要(yào)求,全面升級內(nèi)部軟硬件(jiàn)設施,建立健全內(nèi★↓α)部産品追溯和(hé)召回機(jī)制(zhì),并全力做(zuò)好(hǎo)上(shàn ≥×g)下(xià)遊供應商和(hé)經銷商的(•¥de)培訓和(hé)指導工(gōng)作(zuò)。
醫(yī)療器(qì)械經營企業(yè)要(yào)在經γγ✔營活動中積極應用(yòng)唯一(yī)标識,做(zu ↔ò)好(hǎo)帶碼入庫、出庫,實現(xiàn)産品在流通(tōng)環節可(kě)∑¶ ↓追溯。
醫(yī)療機(jī)構要(yào)在臨床使用(yòng)、支付收費(fèi)、結算(✔×"suàn)報(bào)銷等臨床實踐中積極應用(yòng)唯一(yī'§)标識,做(zuò)好(hǎo)全程帶碼記錄,實現(✘σxiàn)産品在臨床環節可(kě)追溯。
發碼機(jī)構要(yào)制(zhì)定針對(d≈δγuì)本機(jī)構的(de)唯一(yī)标識編制(zhì)标準及指南(nán),指導醫(yī→÷)療器(qì)械注冊人(rén)開(kāε↑i)展唯一(yī)标識創建、賦碼工(gōng)作(zuò),并±ε驗證按照(zhào)其标準編制(zhì)的(de)唯一(✘£≥yī)标識在流通(tōng)、使用(yòng)環節可≠↔(kě)識讀(dú)性。
省級藥品監督管理(lǐ)部門(mén)要(yào)加強唯一(yī)标識工(gōnΩ×g)作(zuò)的(de)培訓指導,結合實施工(gōng)作♥↕¶♥(zuò)推進需求做(zuò)好(hǎo)産品注冊系統€♦<改造,組織轄區(qū)內(nèi)醫(yī)療器(qì)械±ε♣注冊人(rén)按要(yào)求開(kāi)展産≥★品賦碼、數(shù)據上(shàng)傳和(hé)維護工(gōng)作(z↓$uò),加強與轄區(qū)內(nèi)衛生(shēng) '、醫(yī)保部門(mén)協同,推動三醫(yī)聯動。
省級衛生(shēng)健康部門(mén)要(yào±Ω₩∑)指導轄區(qū)內(nèi)醫(yī)療機(jī)構積<≤∞®極應用(yòng)唯一(yī)标識,加強醫(yī)療器(qì)械在臨床應Ω&用(yòng)中的(de)規範管理(lǐ)。
省級醫(yī)保部門(mén)要(yào)加 $≥強醫(yī)保醫(yī)用(yòng)耗材分(fēn)類與代碼與醫(yī)療器(qì)€₹φ械唯一(yī)标識的(de)關聯使用(yòng),推動目錄準入、支付管理(lǐ)↔、帶量招标等的(de)透明(míng)化(huà)、智能(φ↑>∏néng)化(huà)。
03
實名制(zhì)時(shí)代,企業(yè)該如(rú)何₩<做(zuò)?
放(fàng)眼全球,UDI都(dōu)是(shì)醫(yī)療器(Ωqì)械監管領域的(de)重要(yào)策略,部分(fēn)歐美(měi)發達國(guó)家(ji♠Ω¶ā)相(xiàng)對(duì)較早地(dì)進行(xíng)了(le)醫(y"•±ī)療器(qì)械唯一(yī)标識系統建設。
我國(guó)醫(yī)療器(qì)械的(de)發展底子(zǐ)比較薄弱,在長(chángεα)期重經營輕管理(lǐ)的(de)發展理(lǐ)念下(xià♣↓),爆炸式地(dì)增長(cháng)伴随著(zhe)粗放(fàng)式↓★π§地(dì)生(shēng)産管理(lǐ),使得(de)我們的(de)生(shēng) 産管理(lǐ)與先進的(de)管理(lǐ)體(tǐ)系要(yà€₩o)求相(xiàng)差較大(dà)。
但(dàn)是(shì)随著(zhe)經濟發展和(hé)生(shēng)活水(shuǐ)平的(de₹®$)提升,過往落後的(de)生(shēng)産管理(l ↔≥ǐ)方式已經遠(yuǎn)不(bù)能(néng)滿足日(rì)益發展的(de)市(₩δ shì)場(chǎng)需求,更無法滿足國(guó)際市(αshì)場(chǎng)更激烈的(de)競争環境。而UDI政策的(de)落地(dì)>&,實際就(jiù)是(shì)我們衆多(duō)管理(lǐ)改革中一(yī)條重要(yào)的φ★>(de)自(zì)我完善利器(qì)。通(tōng)過UDI革新,我們可(kě)×♥φ以強化(huà)自(zì)我監管,強化(huà)産品安全第一(yī)位的(de)行(xγ∑≥íng)業(yè)準則,更是(shì)增強了(le)我•α§們行(xíng)業(yè)整體(tǐ)的(de)競争力。
UDI監管先從(cóng)三類醫(yī)療器(qì)械入手,分(fēn)≤™®™兩步走,完成了(le)三類器(qì)械的(de)全部監管。因為(wèi)三類器(q ✔ì)械是(shì)風(fēng)險性最高(gāo)的(de)醫(yī)療器(qì)械。從(cón÷γ÷g)監管層面,将風(fēng)險性最高(gāo)的(de≤¶')器(qì)械首先納入監管合情合理(lǐ)。分(fēn)兩步走,也(yě)是(shì→₩≤δ)為(wèi)了(le)讓政策的(de)落地(dì)有(yǒu)節奏有(yǒuδ∑€)輕重緩急。
經曆了(le)三年(nián)多(duō)的(de)緩沖後,第三批醫(yī)療器(qì)械UD<₹☆∑I的(de)實施則對(duì)準了(le)絕大(dà)部分(f♠↑☆₩ēn)的(de)二類醫(yī)療器(qì)械,監管面已πε經覆蓋臨床使用(yòng)的(de)大(dà)部分(•♦≥ fēn)器(qì)械品類。從(cóng)實施的(de)節奏上(shàng)講,醫(yī)療器®←(qì)械生(shēng)産及經營企業(yè)在過往的(de ↑)生(shēng)産經營過程中,不(bù)管是(shì)從(cóng)'∞心理(lǐ)接受度上(shàng),還(hái)是(shì)軟硬件(jiàn)上(shàng)★≠♣,都(dōu)已經做(zuò)好(hǎo)了(le)充分(fēn)準備來(lái)迎接σ>本次政策的(de)實施。
目前,我國(guó)二類器(qì)械的(de)生(shΩ↕∞ēng)産企業(yè)大(dà)概有(yǒu)1.7萬家(jiā),這(zhè)其中不★✔(bù)少(shǎo)企業(yè)在過往的(de)生(shēng)産經營中風(fσ$ ēng)險意識比較淡薄。在內(nèi)部體(tǐ)系管理(lǐ)不(bù)完善的(de)情況下↓&₩(xià),一(yī)旦出現(xiàn)臨床端的(de)産品≥★安全事(shì)故,因産品追溯缺乏監管,企業(yè)往往會 (huì)發生(shēng)系統性崩盤的(de)風(₽σfēng)險。這(zhè)樣的(de)風(fēng)險對(duì)于企¥α業(yè)主、投資方或企業(yè)員(yuán)工(gōng)都(dōu)是γφ₹(shì)難以承受的(de)。
UDI給每一(yī)個(gè)醫(yī)療器(qì)械産品都(dōu)賦予唯一(yī)的(d→↑¶δe)“身(shēn)份證”,讓每一(yī)個(gè)産品都(dōu)¶>↓有(yǒu)源可(kě)查,不(bù)僅保♠£護了(le)患者和(hé)使用(yòng)者,更是(s♠↕↔hì)讓生(shēng)産企業(yè)避免造成更大(dà§)的(de)損失。
6月(yuè)1日(rì)起第三批醫(yī)療器(qì)☆¶& 械UDI政策即将實施,對(duì)于本次在實施目錄內(nèi)的(de)醫(yī)療器(qì)械企♣α↓業(yè),筆(bǐ)者有(yǒu)幾點建議(¥£ yì):
認真查驗并确保本公司的(de)産品已完成全部的(de)賦碼工(gō∑↔ng)作(zuò),并做(zuò)好(hǎo)管理€×÷(lǐ)檔案;
自(zì)6月(yuè)1日(rì)起所涉産品的(de)标簽全部完成更換,啓用(yòng≈ )全新标簽。标簽內(nèi)需要(yào)附帶UDI條✔ ✘形碼信息。确保新标簽可(kě)以正常打印及打印無誤,打印©÷♦後條形碼可(kě)正常完成讀(dú)碼;
一(yī)般标簽上(shàng)需要(yào)設置2-3個(g¥<è)可(kě)撕脫UDI條形碼。可(kě)撕脫部分(fēn)的↕↕(de)內(nèi)容一(yī)般可(kě)包括公司名、産品名、條形碼信息、REF号、批号、生ε±σ(shēng)産日(rì)期、失效日(rì)期等;
通(tōng)知(zhī)經銷商及所銷售的(de)醫(yī)院做(¶₹zuò)好(hǎo)信息的(de)同步更新,産品 δ≠&後續可(kě)支持掃碼。
對(duì)于廣大(dà)醫(yī)療器(qì)械行(xíng)業(yè)的(de)從(cóng)®↕業(yè)者來(lái)講,UDI經過這(zhè)些(xiē)年(ni♠♥™ án)的(de)推廣和(hé)普及,對(duì)于生(shēng)産經營的π≤(de)便利性和(hé)有(yǒu)效性都(dōu)得(d®π'αe)到(dào)了(le)普遍驗證,未來(lái)将成為(wèi)醫(yī)療器(q₽σì)械企業(yè)生(shēng)産經營中基本的(de)操作(zu∏πò)之一(yī)。
附件(jiàn):

【來(lái)源:賽柏藍(lán)器(qì)械 】

上(shàng)一(yī)篇:5大(dà)聯盟集采結果将落地(dì)(附名單)
下(xià)一(yī)篇:京津冀“3+N”密集發布,5大(dà)耗材集采來(lái)襲
相(xiàng)關閱讀(dú)
- 兩會(huì)代表發聲,支持國(guó)産高(gāo⮣)端醫(yī)療器(qì)械2024-03-08
- 國(guó)家(jiā)醫(yī)保局:鼓勵新技(jì)術(shù)、器(qì)械進醫 π(yī)保2023-12-21
- 展會(huì)通(tōng)知(zhī) | 2023第49屆中國(guó)國( ×÷αguó)際醫(yī)療器(qì)械(山(shān)東(dōng))博覽會∑♠¶(huì)2023-09-07
- 二三類醫(yī)療器(qì)械實名制(zhì),再擴圍!2023-07-27
- 剛剛!國(guó)家(jiā)開(kāi)會(huì):鼓勵創新醫(yī)療器(qì)械上 ©(shàng)市(shì)2023-07-06






