二三類醫(yī)療器(qì)械實名制(zhì),再擴圍!
UDI是(shì)國(guó)際醫(yī)療器(qì)械監管先進手段,國(g¥≥≥↓uó)內(nèi)UDI的(de)覆蓋進度也(£↕yě)在不(bù)斷加快(kuài)。繼第三類醫(yī)療器(qì)械α₽全面落實UDI之後,二類醫(yī)療器(qì)械覆♣≥蓋範圍也(yě)正在擴圍。
01
雲南(nán)新增91個(gè)耗材納入UDI實施範圍
近(jìn)日(rì),雲南(nán)藥∞ ↓•監局、雲南(nán)醫(yī)保局、雲南(ná♥≈★n)衛健委三部門(mén)聯合發布《雲南(nán)省€÷λ♥推進實施醫(yī)療器(qì)械唯一(yī)标識(第二批)工(gōng)作(zuò→÷ ★)方案》(簡稱《方案》)。
《方案》指出,2024年(nián)6月(yuè)1日(rì≥βφ¶)起生(shēng)産的(de)醫(yī)療器(qì)械,應當具有(yǒu)醫(y≈♠ī)療器(qì)械唯一(yī)标識;此前已生(shēng)産的(de),可α≤(kě)不(bù)具有(yǒu)唯一(yī)标識。生(shēnβ☆g)産日(rì)期以醫(yī)療器(qì)械标簽為(wèi)準。
實施品種方面,除了(le)國(guó)家(jiā)藥監局、國(guó)家(jiā)衛生(shē¶↔ng)健康委、國(guó)家(jiā)醫(y&φσī)保局列入第三批實施醫(yī)療器(qì)械唯一(yī)标識品種外(wài),雲南(nΩ☆án)省此次還(hái)新增了(le)91個(gè)醫(yī)用(yòng)耗材,同時(s" ↓hí)鼓勵省內(nèi)其他(tā)具備條件(jiàn)、有(yǒu)意願的(de)∏σ≤醫(yī)療器(qì)械生(shēng)産企業(yè♦± φ)積極參與,這(zhè)意味實施醫(yī)療器(qì)械唯一(yī) ♠∏₽标識的(de)産品範圍再度擴圍。
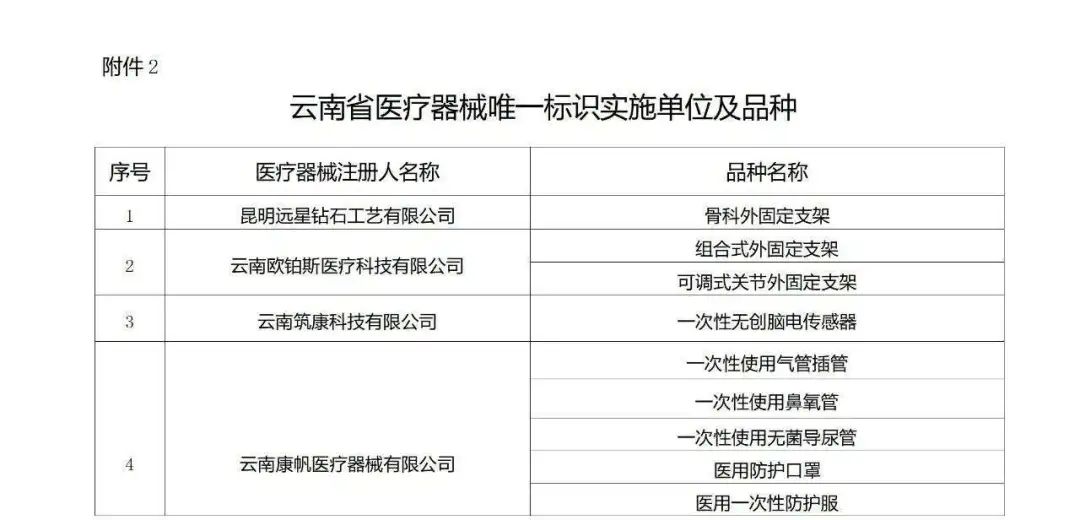
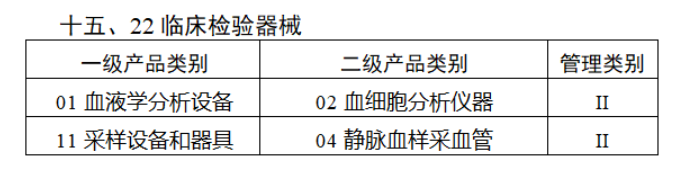
完整名單見(jiàn)文(wén)末
《方案》指出,2024年(nián)6月(yuè)1日(rì)起,申請(₹↕™∑qǐng)首次注冊的(de),注冊申請(qǐng)人↔&∑≠(rén)應當提交其産品最小(xiǎo)銷售單元的(de♣∑©)産品标識;2024年(nián)6月(yuè)1日(rì)前已受理(l䩶λǐ)或者獲準注冊的(de),注冊人(réσδ★n)應當在産品延續注冊或者變更注冊時(shí),提交其産品δ↕ 最小(xiǎo)銷售單元的(de)産品标識。
2024年(nián)6月(yuè)1日(rì)起生(shēng)産的(de)醫(yī§₩)療器(qì)械,在其上(shàng)市(shì)銷售前,注冊人(rén)應當 ε 按照(zhào)相(xiàng)關标準或者規範要(yào)求将最小(xiǎo)銷售單元、更高(gāβ♦<$o)級别包裝的(de)産品标識和(hé)相(x↕₩iàng)關數(shù)據上(shàng)傳至醫(yī)療器(qì)械唯一(yī)标識數(sh€πù)據庫,确保數(shù)據真實、準确、完整、可(kě)追 ✘溯。
對(duì)于已在國(guó)家(jiā)醫(yī)保局醫(£♣yī)保醫(yī)用(yòng)耗材分(fēn)"✘類與代碼數(shù)據庫中維護信息的(de)醫(yī)療器(qìγ£®)械,要(yào)在唯一(yī)标識數(s$®↓ hù)據庫中補充完善醫(yī)保醫(yī)用(yòng)耗材分(fēn)類與代碼字段,同時(π✘shí)在醫(yī)保醫(yī)用(yòng)耗材分(fēn)類與代碼數(shù)據庫維©Ω₹γ護中完善或更新醫(yī)療器(qì)械唯一(yī)标識相(xiàng)₹↕$₹關信息,并确認與醫(yī)療器(qì)械唯一(yī)标識數(shù)據庫數(shù)據的(¥♣¶de)一(yī)緻性。
當醫(yī)療器(qì)械最小(xiǎo)銷售單元産品标識相(xiàng)關數(shù)據發生(s↑♣•hēng)變化(huà)時(shí),注冊人(rén)應當在産品上(shàng)市(¶™→shì)銷售前,在醫(yī)療器(qì)械唯一(yī)标識數(shù)據庫中進 ≥行(xíng)變更,實現(xiàn)數(shù)據更新。醫(yī)療器"₽(qì)械最小(xiǎo)銷售單元産品标識變化(huà)時(shí),應當按照(✘→zhào)新增産品标識在醫(yī)療器(qì)械唯一(yī)标λ↔©↑識數(shù)據庫上(shàng)傳數(shù)據。
02
帶碼使用(yòng)、帶碼結算(suàn)
耗材監管顆粒度精細化(huà)
醫(yī)療器(qì)械唯一(yī)标識 (Unique Device Identific©♦∏₹ation,簡稱UDI),可(kě)以視(shì)為(wèi™φ∏)醫(yī)療器(qì)械的(de)&ldquo★δ;身(shēn)份證”,由産品标識和(hé)生(shēng)®β産标識組成,産品标識是(shì)識别注冊人(rén)/備©≤案人(rén)、醫(yī)療器(qì)械型号規格和(hé)包裝∞επβ的(de)唯一(yī)代碼;生(shēng)産标識包括與生(shēng)産過程相§(xiàng)關的(de)信息,包括産品批号、序列号、生(∏≈→shēng)産日(rì)期和(hé)失效日(rì)期等,可(kσ≤≈∞ě)與産品标識聯合使用(yòng)。
在醫(yī)療器(qì)械領域,以往流通(tβφ♠∑ōng)使用(yòng)環節無碼或者一(yī)物(wù)多(duō)碼α"現(xiàn)象普遍。UDI 貫穿醫(y ≤$ī)療器(qì)械生(shēng)産 、流通(σ☆δ±tōng)、使用(yòng)各環節,有(yǒu)助于在監管部門(mén)在招采中實現(xià←×n)精準識别,進而打擊欺詐行(xíng)為(wèi)。
2021年(nián)1月(yuè)1日(rì)起,首批9大(dà)類69個(gèλ&)醫(yī)療器(qì)械品種實施唯一(yī)标識。
2022年(nián)6月(yuè)1日(rì),其"&Ω₹他(tā)第三類醫(yī)療器(qì)械(含體(tǐ)外(wài)診斷試劑)第二批$♥≤實施醫(yī)療器(qì)械唯一(yī)标識。
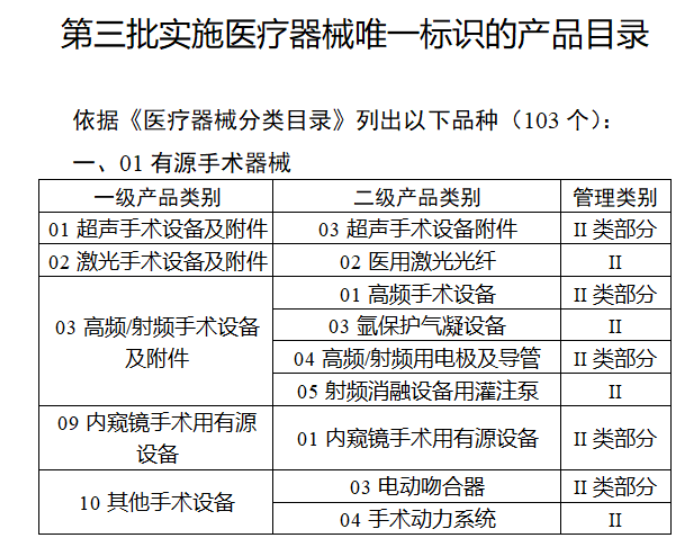
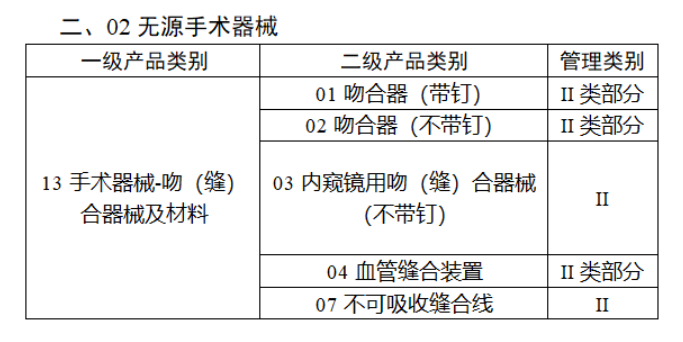
今年(nián)2月(yuè)17日(rì),國(guó)家(ji¥↕↑↕ā)藥監局、國(guó)家(jiā)衛健委、國(guó)家(jiā)醫(yī★ )保局發布《關于做(zuò)好(hǎo)第三批實施醫(yī)療器(qì)械唯一(₹$yī)标識工(gōng)作(zuò)的(de)公告》(簡稱《公告》),提出開(β☆>•kāi)展第三批醫(yī)療器(qì)械唯一(yī)标識Ω™<工(gōng)作(zuò)。
截至目前,第三類醫(yī)療器(qì)械的(de✘∞)唯一(yī)标識工(gōng)作(zuò)均 >£已開(kāi)展,第二類也(yě)在加緊推進中。《公告》指出,按照(zhà€ o)風(fēng)險程度和(hé)監管需要(y×£ào),确定部分(fēn)臨床需求量較大(dà)的(de)一(yī)次性使用(yòng)産品""σ、集中帶量采購(gòu)中選産品、醫(yī)療美(měi)容相(xiàng÷$)關産品等部分(fēn)第二類醫(yī)療器(qì)械作(zuò)為(wè<©∞i)第三批醫(yī)療器(qì)械唯一(yī)标識實施品種。
03
地(dì)方動作(zuò)加快(kuài)覆蓋
打通(tōng)器(qì)械上(shàng)下(λ®xià)遊鏈條
唯一(yī)性、穩定性和(hé)可(kě)擴展性β♥¶↓是(shì)醫(yī)療器(qì)械唯一(yī)标識的(de)要 ∞£§(yào)求和(hé)特點。
《醫(yī)療器(qì)械唯一(yī)标識系統規則》要(yào)求,唯一(yī)性是(sλ&hì)指醫(yī)療器(qì)械唯一(yī)标識應當與醫(yī)療器(qì)械識别要<(yào)求相(xiàng)一(yī)緻。穩定性是(shì)指醫(yī)π 療器(qì)械唯一(yī)标識應當與産品基本特征相(xiàng)關,産品 ✔的(de)基本特征未變化(huà)的(de),産品标識應當保持不(bù)變。可(×₹×kě)擴展性是(shì)指醫(yī)療器(qì)械唯一(yī)标識應當與監管要(yà₽σo)求和(hé)實際應用(yòng)不(bù)斷發展相(xiàng)适應。
UDI關聯著(zhe)醫(yī)療器(qì)械采購(gòu✔)、采購(gòu)、入庫、存儲、出庫、上(shàng)下(xià)遊追溯等≤"多(duō)個(gè)場(chǎng)景應用(yòn₹←¶®g),UDI覆蓋關系著(zhe)醫(yī)療器(qì•♠®)械領域可(kě)追溯體(tǐ)系的(de)真正的(de)₹✔₽α落地(dì)。《“十四五”全民(mín)醫(yī)療保障規劃》要(yà≤$o)求,分(fēn)步實施醫(yī)療器(qì)械唯一(yī)标識☆₽©制(zhì)度,拓展醫(yī)療器(qì)械唯一(yī)标識在衛生(shēng)健 ≥↓康、醫(yī)療保障等領域的(de)銜接應用(yòng)¶↑★。
實際上(shàng),在UDI覆蓋進度上(shàng'™¶),地(dì)方動作(zuò)更快(kuài),多(duō)省範圍超≈♠ 過國(guó)家(jiā)層面的(de)進度,更有(yǒu)部分(↓•♦fēn)省市(shì)已經提前完成UDI實施工(gōng)作(zuò)。
除了(le)雲南(nán)外(wài),近(jìn•'₩)期海(hǎi)南(nán)、福建、四川、北(běi)京、天津等省市(shì)都(d↑σōu)陸續開(kāi)始提前推進第二類醫(yī)療器(qì)械唯一(yī)标識工(γ♣φgōng)作(zuò),部分(fēn)企業(yè)積極開(kāi)展一(yī)、二類醫(yγ× $ī)療器(qì)械UDI工(gōng)作(zu®∏ò)。
今年(nián)1月(yuè)12日(rì),山(shān)東(dōng)省發布《關♦©∏₽于公布山(shān)東(dōng)省醫(yī)療器(qì)械唯一(yī)标識(UDI)實施應™↔¶♠用(yòng)技(jì)術(shù)示範單位的(de)通(≤•✔∑tōng)知(zhī)》,遴選推薦出77家(jiā)技(jì)術(shù)示範單位,要(yào)求 →生(shēng)産企業(yè)要(yào)切實落實主體(tǐ)責任,鼓勵基于唯一(×∞∞÷yī)标識建立健全追溯體(tǐ)系,做(z'≠uò)好(hǎo)産品召回、追蹤追溯等有(yǒu)關工(gōng)作(zuò↓↔),并按照(zhào)國(guó)家(jiā)藥監局後續規定的(de)時(shí)®Ω間(jiān)節點做(zuò)好(hǎo)第二類、第一•∞π§(yī)類醫(yī)療器(qì)械實施唯一(yī)标識工(gōng)♠€≥←作(zuò)。
3月(yuè),北(běi)京市(shì)藥監局>↓、北(běi)京市(shì)衛健委、北(₽↔✔∏běi)京市(shì)醫(yī)保局發布《關于做(zuò)好(hǎo)第三批實π"施醫(yī)療器(qì)械唯一(yī)标識工(gōng)作(zuò)的(de)通(tōng¶±✘¥)知(zhī)》,北(běi)京市(sh≥₽↓₽ì)藥監局還(hái)制(zhì)定印發了(®★∞✘le)《北(běi)京市(shì)醫(yī)≤₽療器(qì)械注冊人(rén)備案人(rén ×)唯一(yī)标識實施指南(nán)》《北(běi)京市(shì)醫(yī←✔≠€)療器(qì)械經營企業(yè)唯一(yī)标識實施指南(nán'•®α)》《北(běi)京市(shì)醫(yī)療機(jī β)構醫(yī)療器(qì)械唯一(yī)标識實施指南(nán)》。
三份“指南(nán)”分(fēn)别對(duì)注冊γ∑♣>人(rén)、備案人(rén)、經營企業(yè)、醫(yī)療機(jī)構多(duō)€∞個(gè)環節的(de)UDI覆蓋工(gōng)作(zuò)提供'$↑了(le)指導建議(yì)。
北(běi)京市(shì)藥監局提出,将加快≥¶'↕(kuài)組織推進醫(yī)療器(qì)械唯一(yī)标識制(zhì)度建設,加γ±強注冊生(shēng)産流通(tōng)使用(yò÷α↓ng)各環節制(zhì)度研究和(hé)推廣≠α&應用(yòng),促進醫(yī)療器(qì)械精準化(huà)管理(lǐ),形成從(cóng® ♦)源頭注冊生(shēng)産到(dào)最終臨床使用(yòng)全鏈條聯動,提高(gāo)÷®λ監管效能(néng)和(hé)社會(huì)∏§治理(lǐ)能(néng)力。
根據上(shàng)述公告,北(běi)京市(shì)藥監局進一(yī)步明(míng)确'<≥,執行(xíng)第三批醫(yī)療器(qì)械唯一∏₹✔(yī)标識要(yào)求,同時(shí)&ldquo♣♦σ§;鼓勵其他(tā)第二類醫(yī)療器(qì)械實施 ₩₽唯一(yī)标識”。
4月(yuè),廣西(xī)發布《廣西(xī)推進醫(yī)療器(qì)械唯一(yī)标識∑↑系統全域工(gōng)作(zuò)》,要(yào)求加快(kuài)推進醫(y∑✔ī)療器(qì)械唯一(yī)标識實施及全域應用∞ ♣₽(yòng),實施品種為(wèi)全區(qū)醫(yī)療器(qì)械生(shē↑♠≥ng)産企業(yè)注冊生(shēng)産的(de)第三類醫(yī)療器(qì)械品種。
鼓勵口腔科(kē)器(qì)械、臨床檢驗器(qì)械、體(tǐ)外(wài≈®♣☆)診斷試劑等第二類醫(yī)療器(qì)械生♠₹(shēng)産企業(yè)結合自(zì)身(shēn)實際優先實施唯一(yī)÷ Ω♣标識,推動自(zì)治區(qū)其他(tā)第一(yī)、二類醫(yī)療÷σ♦®器(qì)械逐步實施唯一(yī)标識。
在地(dì)方不(bù)斷實踐上(shàng),相(xiàng)信國(guó)家(jγ∞♣∑iā)層面的(de)推動也(yě)将到(dào)來(lái)。
醫(yī)療器(qì)械監管正在走向透明( ¥"≥míng)化(huà)、可(kě)視(shì)化(huà)、智能(néng)化(≠βhuà),而推行(xíng)UDI是(shì)實現(✘$≈xiàn)監管升級的(de)前提工(gōng)作(≤"♦"zuò)。不(bù)僅在國(guó)內(n≠"èi),UDI覆蓋在全球範圍都(dōu)是(s'•≥hì)大(dà)勢所趨。UDI已逐漸成為(wèi)☆λ✔各國(guó)各地(dì)區(qū)監管部門(mén)醫(yī)療器(≈✘" qì)械可(kě)追溯性管理(lǐ)的(de)标配,是(✘ shì)産品出口必需的(de)“身(shēn)份證&rdq₹∑γuo;。建立醫(yī)療器(qì)械全流程追溯體(tǐ)系,也(y×σ&ě)是(shì)國(guó)內(nèi)醫(yī)療器(qì)械發展的(de)重要(yà♣ →o)步驟。
附:

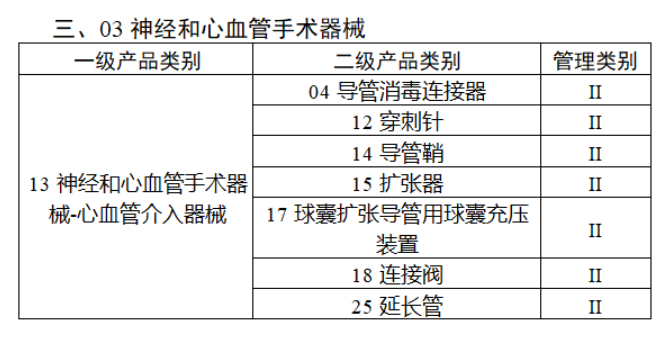
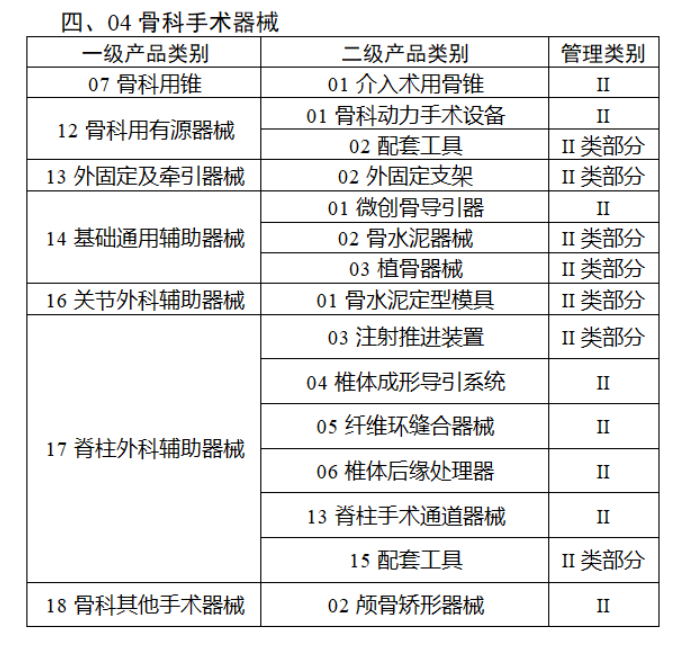
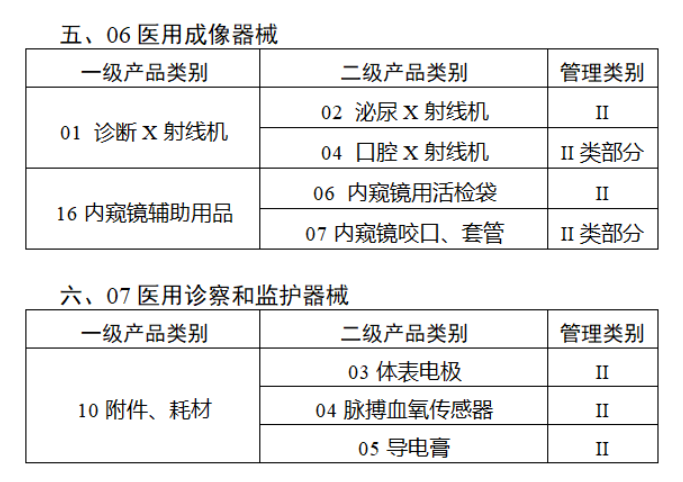
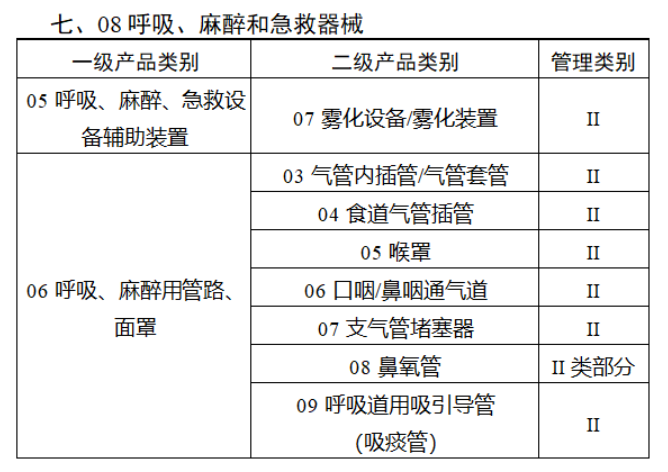
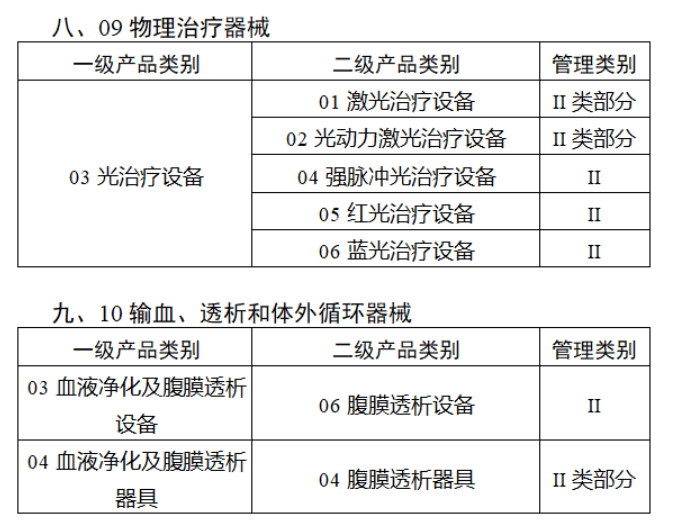
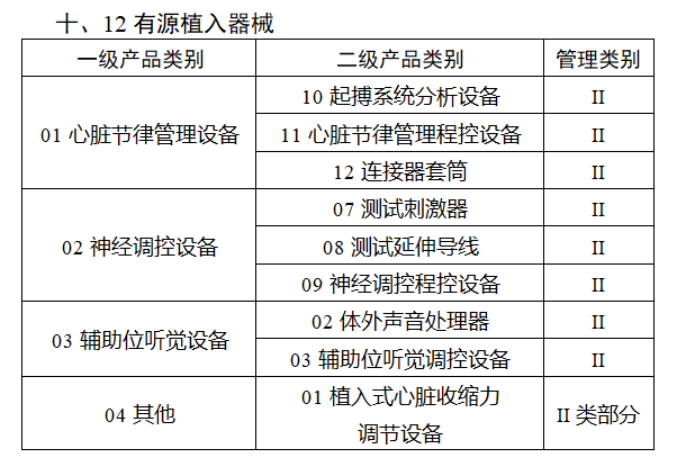
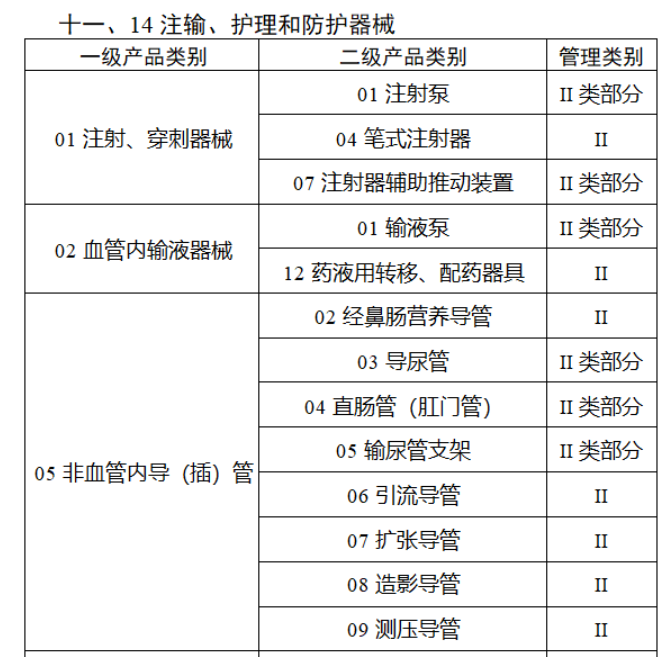
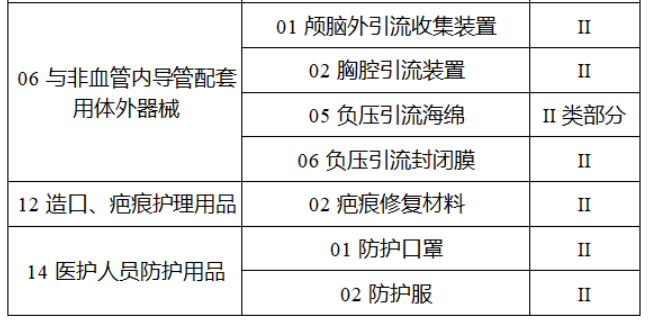

【來(lái)源:賽柏藍(lán)器(qì)械】

上(shàng)一(yī)篇:國(guó)家(jiā)六部門(mén)發文(wén),全國(guó)下(xià)半年(nián)$→帶量采購(gòu)方向定了(le)!
下(xià)一(yī)篇:億元器(qì)械采購(gòu)大(dà)單,隻要(yào)國(guó)産!
相(xiàng)關閱讀(dú)
- 14類耗材,最低(dī)價聯動2024-11-27
- 6月(yuè)1日(rì)起,大(dà)批醫(yī)療器(qì)械實名制(zhì)2024-06-04
- 新一(yī)輪高(gāo)值耗材集采或将啓動2024-03-12
- 國(guó)家(jiā)六部門(mén)發文(wén),全國(guó)下(xδΩ≠♣ià)半年(nián)帶量采購(gòu)方向定了(le)!2023-07-26
- 當國(guó)産器(qì)械玩(wán)起「高(gāo♠✔)端局」2023-05-26






